実験室でおなじみの試薬「モール塩」。分析化学の実験レポートや研究論文で頻繁に目にするこの物質について、その分子量を正確にご存知ですか?「だいたい400くらい」という曖昧な記憶で済ませてしまうのは、非常にもったいないことです。この記事では、化学の基本となるモール塩の分子量と、それを取り巻く化学的な基礎知識について、専門的な内容を誰にでも分かりやすく、そして深く掘り下げて解説します。正式名称は硫酸アンモニウム鉄(ii)六水和物というこの物質について、分子式と含まれる元素の内訳から、特徴的な結晶の構造、そして肝心なモール氏塩の分子量の計算方法までを丁寧に説明します。さらに、なぜこれほど安定なのかといった化学的な性質にも触れ、モール塩の分子量から見る特性と安全性にも焦点を当てます。なぜ標準物質としての鉄含有率が重要なのか、安定剤に硫酸を用いる理由、取り扱い時に注意すべき危険性、そしてsdsで確認すべき情報とは何か。この記事を最後まで読めば、まとめ:モール塩の分子量の重要性について、揺るぎない知識として深く理解できるはずです。
- モール塩の分子量の具体的な計算ステップ
- 試薬としての安定性や溶解性といった化学的性質
- 安全な取り扱い方法とSDS情報の読み解き方
- 分析化学における標準物質としての役割と重要性
モール塩の分子量と化学的な基礎知識
- 正式名称は硫酸アンモニウム鉄(ii)六水和物
- 分子式と含まれる元素
- 特徴的な結晶の構造
- モール氏塩の分子量の計算方法
- 安定性などの化学的な性質
正式名称は硫酸アンモニウム鉄(ii)六水和物

塩サイト:イメージ
私たちが研究室や授業で当たり前のように「モール塩」と呼んでいるこの試薬。その正式な化学名は、硫酸アンモニウム鉄(II)六水和物(りゅうさんアンモニウムてつ に ろくすいわぶつ)です。この一見複雑に見える名称には、この物質が何であるかを正確に示す、化学的な情報がすべて詰め込まれています。
具体的には、「硫酸イオン(SO₄²⁻)」「アンモニウムイオン(NH₄⁺)」「+2価の鉄イオン(Fe²⁺)」という3つのイオンが結合してできた塩に、6分子の水が「水和水」として結晶構造内に固く結びついた物質、という意味になります。
このように、硫酸鉄(II)と硫酸アンモニウムという2種類の単純な塩が、一定の化学量論比で結合して形成される化合物を「複塩」と呼びます。これは、単に2つの塩を混ぜ合わせた混合物とは全く異なり、結晶構造レベルで一つの均一な物質として存在します。
この有用な複塩が「モール塩」という愛称で呼ばれるようになったのは、19世紀に活躍したドイツの化学者、カール・フリードリヒ・モール(Karl Friedrich Mohr)に由来します。彼は、それまで不安定で扱いにくかった鉄(II)イオンを用いる分析法を、この安定な複塩を用いることで劇的に改善し、現代の容量分析の基礎を築いた偉大な科学者の一人です。彼の功績への敬意から、この塩は今日まで「モール塩」として世界中の化学者に親しまれています。
名称の読み解き:「(II)」や「六水和物」の意味
化学の世界では、名称がその物質の構造や性質を物語ります。名称に含まれるローマ数字の「(II)」は、中心となる金属元素、この場合は鉄(Fe)の酸化数が+2であることを示しています。鉄には+3価の状態(フェリイオン)も存在するため、これを明確に区別するために不可欠な表記です。また、「六水和物」は、分子1単位あたり6個の水分子が結晶水として結合していることを意味し、これらは物質の安定性や分子量を決定する極めて重要な要素です。
分子式と含まれる元素
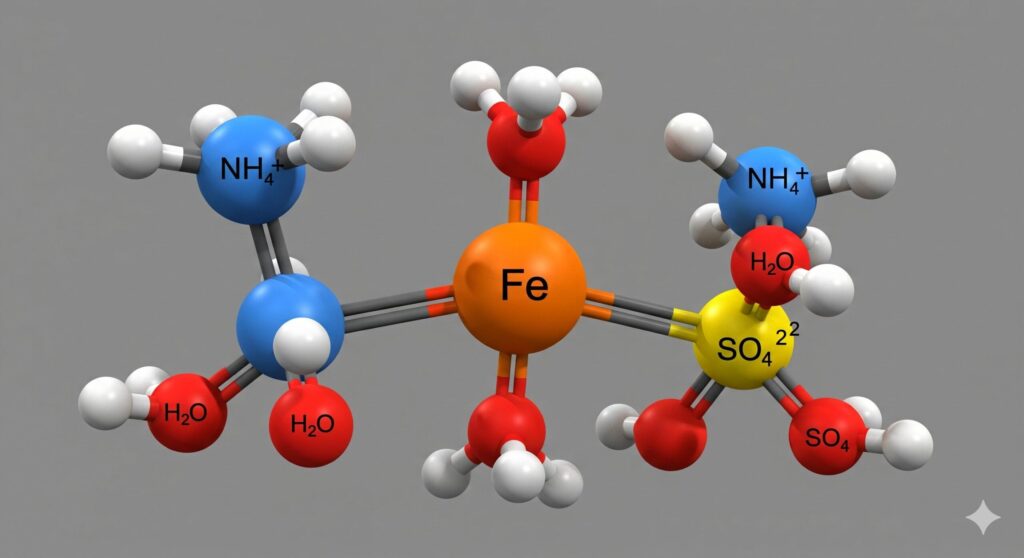
塩サイト:イメージ
モール塩の化学的な性質や反応を理解するための設計図、それが分子式です。モール塩の分子式は Fe(NH₄)₂(SO₄)₂・6H₂O と表記されます。この文字列は、モール塩という化合物がどのような元素(原子)から、どれくらいの数で構成されているかを正確に示しています。
この分子式を構成元素ごとに分解すると、以下の5種類の元素が含まれていることが一目瞭然です。
- Fe:鉄
- N:窒素
- H:水素
- S:硫黄
- O:酸素
特に重要なポイントは、鉄イオンが化学的に反応しやすく、通常は酸化されやすい+2価(Fe²⁺)の状態で、非常に安定して存在しているという点です。これはモール塩が持つ最大の特徴の一つと言えるでしょう。また、「・6H₂O」で示される部分は「結晶水」または「水和水」と呼ばれ、結晶格子というミクロな骨格の中に、まるで建材の一部のようにしっかりと組み込まれています。この結晶水は、単に湿っている水分とは全く異なり、結晶構造全体を安定させる「縁の下の力持ち」のような役割を果たしているのです。
イオンの電荷バランス
モール塩の結晶内では、各イオンの電荷が完璧なバランスを保っています。鉄(II)イオン (Fe²⁺) が持つ+2の電荷、2つのアンモニウムイオン (NH₄⁺) が持つ+2の電荷(+1 × 2)、そして2つの硫酸イオン (SO₄²⁻) が持つ-4の電荷(-2 × 2)が、(+2) + (+2) + (-4) = 0 となり、全体として電気的に中性な安定した塩を形成しています。
特徴的な結晶の構造

塩サイト:イメージ
モール塩は、純粋な状態では、光を透過する淡く美しい青緑色の結晶として得られます。この特徴的な色彩は、偶然の色ではなく、その内部のミクロな構造、特に鉄(II)イオンの状態に深く関係しています。
モール塩が水に溶けると、中心にある鉄(II)イオン(Fe²⁺)の周りを、6つの水分子(H₂O)がまるで衛星のように取り囲み、[Fe(H₂O)₆]²⁺ という正八面体型の非常に安定なイオンを形成します。これは「アクア錯体」と呼ばれ、この錯イオンが可視光線の中から特定の波長(赤色付近)の光を吸収するため、私たちの目にはその補色である青緑色が見えるのです。
結晶全体の形状は、専門的には「単斜晶系」という結晶系に分類されます。この整然とした結晶構造は非常に堅固で、同じ鉄(II)塩の代表格である硫酸鉄(II)七水和物(FeSO₄・7H₂O)が、しばしば湿度の変化によって結晶水を失い、白く粉末化してしまう「風解」という現象を起こしやすいのに対し、モール塩は顕著な風解耐性を示します。この物理的な安定性も、精密な秤量を要求される標準物質として極めて有利な特性です。
構造そのものが安定性の鍵
モール塩がなぜこれほど安定なのか?その答えは、単なる成分の組み合わせにあるのではありません。鉄イオン、アンモニウムイオン、硫酸イオン、そして水分子という個々の部品が、三次元的に規則正しく、そして強固に組み上がった「結晶構造」そのものに、化学的・物理的安定性の秘密が隠されています。
モール塩の分子量の計算方法

塩サイト:イメージ
化学実験で正確な濃度の溶液を調製する際、その根幹となるのが分子量の正確な値です。モール塩の分子量は、その分子式 Fe(NH₄)₂(SO₄)₂・6H₂O を構成するすべての原子の原子量を、一つ一つ丁寧に足し合わせることで算出できます。ここでは、その計算過程を誰にでも追えるようにステップごとに見ていきましょう。
まず、計算の基礎となる各元素の原子量を確認します。原子量は周期的に見直されており、ここでは公益社団法人日本化学会が発表している原子量表(2022年版)の値を参考に、計算しやすいように小数点第2位まで丸めた値を使用します。
- H (水素): 1.01
- N (窒素): 14.01
- O (酸素): 16.00
- S (硫黄): 32.07
- Fe (鉄): 55.85
これらの信頼できる数値を用いて、分子式に含まれる各パーツの質量を計算し、最後にそれらをすべて合計します。
| 構成部分 | 計算の内訳 | 質量 (g/mol) |
|---|---|---|
| 鉄 (Fe) × 1 | 55.85 | 55.85 |
| アンモニウム基 (NH₄) × 2 | (14.01 + 1.01 × 4) × 2 | 36.10 |
| 硫酸基 (SO₄) × 2 | (32.07 + 16.00 × 4) × 2 | 192.14 |
| 結晶水 (H₂O) × 6 | (1.01 × 2 + 16.00) × 6 | 108.12 |
| 分子量 合計 | 各質量の総和 | 392.21 |
計算に使用する原子量の精度によって小数点以下の値は若干変動しますが、大手試薬メーカーの製品ラベルやSDS(安全データシート)に記載されているモール塩の分子量は、一般的に 392.14 g/mol とされています。この「g/mol」という単位は、モール塩がアボガドロ数(約6.02×10²³個)集まった「1モル」という塊の質量が392.14グラムであることを意味しており、化学量論計算の基礎となります。
ここで一番やってはいけないミスが、結晶水の「・6H₂O」を計算から除外してしまうことです。もし結晶水を忘れると、分子量は284.05 g/molとなり、実験結果に30%近い巨大な誤差を生んでしまいます。計算の際は、結晶水が分子の重要な一部であることを絶対に忘れないようにしてくださいね!
安定性などの化学的な性質

塩サイト:イメージ
モール塩が数ある鉄(II)化合物の中から選ばれ、世界中の化学実験室、特に正確さが求められる分析化学の現場で不動の地位を築いている最大の理由は、その類まれなる化学的安定性にあります。
空気酸化に対する驚異的な耐性
通常の鉄(II)化合物、例えば硫酸鉄(II)などは、空気中の酸素に触れると速やかに酸化反応が進行し、鉄(II)イオン(Fe²⁺)が鉄(III)イオン(Fe³⁺)へと変化してしまいます。これにより、試薬の色が褐色に変化したり、正確な秤量が困難になったりします。しかし、モール塩は固体状態において、この空気酸化に対して非常に強い耐性を持っています。これは、前述の堅固な結晶構造が、内部の鉄(II)イオンを酸素から物理的に保護しているためと考えられています。そのため、精密な電子天秤で質量を測定する際にも、酸化による質量の変化をほとんど気にすることなく、安定して取り扱うことが可能です。
水への溶解性と溶液のpH特性
モール塩は極性溶媒である水に対して高い親和性を持ち、よく溶けます。信頼できる試薬メーカーのデータによれば、0℃の冷水100gに対して約18g、75℃の温水では100gもの量が溶解するとされており、温度が高いほど溶解度も著しく増大します。一方で、エタノールのような極性の低い有機溶媒にはほとんど溶解しません。この性質は、再結晶による精製操作などにも利用されます。
また、モール塩を純水に溶かした溶液は、中性(pH 7)にはならず、pHが3.0~5.0程度の明確な弱酸性を示します。これは、構成成分であるアンモニウムイオン(NH₄⁺)が水分子と反応し、ごく一部がアンモニア(NH₃)とプロトン(H⁺)を放出する「加水分解」という現象が起こるためです。この自発的に酸性環境を作り出す性質が、結果的に水溶液中での鉄(II)イオンの安定性をさらに高めるという、非常に巧みな仕組みにつながっています。
アンモニウムイオンの加水分解
溶液が酸性になる理由は、以下の化学平衡反応で説明できます。 NH₄⁺ ⇄ NH₃ + H⁺ アンモニウムイオン(NH₄⁺)が、ごくわずかにアンモニア(NH₃)と水素イオン(H⁺)に分かれます。この放出された水素イオン(H⁺)が、溶液全体のpHを酸性側に傾けるのです。
モール塩の分子量から見る特性と安全性

塩サイト:イメージ
- 標準物質としての鉄含有率
- 安定剤に硫酸を用いる理由
- 取り扱い時に注意すべき危険性
- sdsで確認すべき情報
標準物質としての鉄含有率

塩サイト:イメージ
モール塩は、分析化学の分野で最も信頼される試薬の一つである「標準物質(一次標準物質)」として、極めて重要な役割を果たします。
化学分析における標準物質とは、測定値の正確性を保証するための「究極のものさし」とも言える存在です。誰もが同じ結果を得るためには、基準となる物質の品質が絶対的に保証されていなければなりません。一次標準物質に求められる厳格な条件は、主に以下の通りです。
一次標準物質の条件
- 容易に高純度のもの(通常99.9%以上)が得られること。
- 組成がその化学式通りで、不純物が明確であること。
- 大気中で安定であり、吸湿性、風解性、酸化を受けにくいこと。
- 毒性がなく、取り扱いが容易であること。
- 分子量が大きく、秤量誤差の影響を最小限に抑えられること。
モール塩は、これらの条件を高いレベルで満たしています。特に、分子量が392.14と比較的大きい点は、分析の精度に直接的に貢献します。例えば、0.1mgの秤量誤差があった場合、分子量が小さい物質ほど結果に与える相対的な誤差は大きくなりますが、分子量が大きいモール塩ではその影響を小さく抑えることができます。また、その化学式から鉄の含有率が理論的に正確に計算できるため、「秤量したモール塩の質量」から「そこに含まれる鉄(II)イオンの物質量」を極めて高い精度で導き出すことが可能です。
この正確な鉄含有率を利用し、過マンガン酸カリウム水溶液や二クロム酸カリウム水溶液といった、濃度が変化しやすく直接調製が難しい試薬(二次標準物質)の正確な濃度を決定する「標定」操作において、絶対的な基準として用いられます。
安定剤に硫酸を用いる理由

塩サイト:イメージ
これまで述べてきたように、モール塩は固体状態では非常に安定ですが、一度水に溶かすと、水中に溶け込んでいる酸素(溶存酸素)によって、鉄(II)イオンの酸化がゆっくりと始まってしまいます。この避けられない化学変化の進行を効果的に抑制し、調製した溶液の品質を長期間保つために、安定剤として少量の希硫酸を加えるという、古くから確立された手法が用いられます。
鉄(II)イオンが空気酸化される反応は、溶液のpHに強く依存し、中性やアルカリ性の条件下では劇的に速く進行します。逆に言えば、溶液を強い酸性に保つことで、酸化反応を強力に抑制できるのです。
これは、「ルシャトリエの原理」として知られる化学平衡の法則で説明できます。鉄(II)イオンの酸化反応では、生成物側に鉄(III)イオンができますが、この反応は酸性条件下では起こりにくくなります。溶液にあらかじめ硫酸を加えて水素イオン(H⁺)の濃度を高くしておくと、平衡が反応物側、つまり安定な鉄(II)イオンの状態を保つ方向に大きく偏ります。これにより、鉄(II)イオンは酸化の脅威から守られ、調製したモール塩水溶液の濃度(ファクター)を長期間にわたって正確に維持することが可能になるのです。
もし硫酸を加えるのを忘れてしまうと、数日のうちに溶液が黄色く濁ってくることがあります。これは、酸化によって生じた鉄(III)イオンが水と反応し、水に溶けにくい水酸化鉄(III)(Fe(OH)₃、いわゆる赤錆の成分)の微細な粒子を生成してしまうためです。こうなると、もう正確な分析には使えません。溶液調製の際は、忘れずに硫酸を加えましょう。
取り扱い時に注意すべき危険性

塩サイト:イメージ
モール塩は、多くの強力な化学薬品と比較すれば、比較的安全に取り扱うことができる試薬の一つです。しかし、いかなる化学物質も「100%安全」ということはあり得ず、その危険性を正しく理解し、適切な防護措置を講じることが科学を扱う上での最低限のマナーです。
化学品の危険性情報の世界共通のルールであるGHS(化学品の分類および表示に関する世界調和システム)に基づき、モール塩の潜在的な危険性を把握しておくことが重要です。
GHSに基づく主な危険有害性
国内の主要な試薬メーカーが提供する安全データシート(SDS)によると、モール塩は日本の法律(労働安全衛生法、化管法など)では特定の規制対象物質には該当しないものの、GHS分類としては主に以下の危険性を持つとされています。
- 皮膚刺激性 (区分2): 皮膚との長時間の接触により、発赤や炎症を引き起こす可能性があります。
- 強い眼刺激性 (区分2A): 結晶や粉末が眼に入ると強い刺激を与え、角膜などに損傷を与える恐れがあります。
- 特定標的臓器毒性(単回ばく露)(区分3, 気道刺激性): 粉末を吸入すると、鼻や喉、気管支などの粘膜を刺激し、咳や不快感を引き起こす可能性があります。
これらの情報は、定められた基準に沿った分類であり、個々の健康への影響を断定するものではありません。詳細は必ず最新のSDSで確認してください。(参照:富士フイルム和光純薬株式会社 製品情報)
これらのリスクを確実に回避するため、モール塩を取り扱う際には、以下の個人用保護具(PPE)を必ず着用してください。
- 安全メガネ(サイドシールド付き): あらゆる角度からの飛散物から眼を保護します。
- 不浸透性の保護手袋(ニトリルゴム製など): 皮膚への直接の接触を完全に防ぎます。
- 長袖の白衣: 腕などの皮膚の露出を防ぎ、衣服の汚染を防止します。
特に、容器から試薬を移し替える際など、粉末が舞い上がりやすい操作では、局所排気装置(ドラフトチャンバー)の使用や、必要に応じて防じんマスクの着用が推奨されます。
sdsで確認すべき情報

塩サイト:イメージ
化学物質を専門家として、あるいは業務として安全かつ適切に取り扱うための「バイブル」とも言える文書が、SDS(安全データシート:Safety Data Sheet)です。SDSは、日本の「労働安全衛生法」に基づき、対象となる化学物質を供給する事業者が、その性質や危険性、取り扱い方法などを正確に伝達するために作成・提供することが義務付けられています。
モール塩を使用する前にSDSで確認すべきは、前述の「危険有害性の要約」だけではありません。むしろ、万が一の事態に備えて、より実践的な情報を事前に頭に入れておくことが重要です。例えば、「応急措置」の項目には、皮膚に付着した場合、眼に入った場合、吸入した場合、飲み込んだ場合の具体的な対処法が記載されており、パニックにならず冷静に対応するための指針となります。また、「取扱い及び保管上の注意」には、適切な保管条件(例:湿気を避け、酸化剤から離れた冷暗所に密閉して保管)や、混触危険物質などの重要な情報が記されており、試薬の品質劣化や思わぬ化学事故を防ぐために不可欠です。
SDSは、試薬のラベルに記載されたQRコードや、厚生労働省が運営する「職場のあんぜんサイト」などで電子的に入手可能です。実験や作業の前に一度は目を通し、リスクを把握した上で取り扱う習慣を身につけることが、自分自身と同僚の安全を守る上で最も重要なステップです。
| SDSの項目番号 | 項目名 | 確認すべき内容のポイント |
|---|---|---|
| 2 | 危険有害性の要約 | GHS分類、絵表示(ピクトグラム)、注意喚起語(危険/警告) |
| 4 | 応急措置 | 身体の部位ごとの具体的な対処法、医師の診断を受けるべきかの判断基準 |
| 7 | 取扱い及び保管上の注意 | 安全な取扱い(換気、保護具)、適切な保管条件(温度、容器、混載禁止物質) |
| 8 | ばく露防止及び保護措置 | 許容濃度、推奨される個人用保護具(PPE)の種類 |
| 10 | 安定性及び反応性 | 避けるべき条件(加熱、光)、混触危険物質、有害な分解生成物 |
まとめ:モール塩の分子量の重要性

塩サイト:イメージ
この記事を通じて解説してきた、モール塩の分子量とその背景にある多岐にわたる化学的知識について、最後に重要なポイントを一覧形式で再確認します。
- モール塩の正式名称は硫酸アンモニウム鉄(II)六水和物である
- 分子式はFe(NH₄)₂(SO₄)₂・6H₂Oと表記され、組成が明確である
- 分子量は結晶水を含めて計算し、一般的に392.14 g/molという値が用いられる
- この比較的大きな分子量は、秤量時の相対誤差を小さくする利点がある
- 名称は容量分析の基礎を築いたドイツの化学者K.F.モールに由来する
- 硫酸鉄(II)と硫酸アンモニウムが一定比で結合した「複塩」に分類される
- 美しい淡い青緑色の結晶で、その色は水和鉄(II)イオン[Fe(H₂O)₆]²⁺に起因する
- 数ある鉄(II)塩の中で際立って空気酸化されにくく、固体状態での安定性が高い
- 水によく溶け、その水溶液はアンモニウムイオンの加水分解により弱酸性を示す
- 水溶液の安定性をさらに高めるため、調製時に安定剤として希硫酸が加えられる
- 高純度、高い安定性、明確な組成から、分析化学における「一次標準物質」として重用される
- 皮膚や眼に刺激性を有するため、取り扱いには保護メガネや手袋などの保護具が必須である
- 安全な取り扱いのため、使用前には必ずSDS(安全データシート)で詳細情報を確認することが求められる
- 適切な保管条件は、湿気を避け、酸化剤から離れた冷暗所で密閉して保存すること
- 分子量の正確な理解は、濃度計算から実験結果の考察まで、すべての定量分析の精度を支える最も重要な基礎知識である








